La estreptavidina es una proteína tetramérica expresada en Streptomyces avidinii. Debido a su alta afinidad por la vitamina h-biotina, la estreptavidina se utiliza habitualmente en los campos de la biología molecular y la biotecnología. El Strep-tag se seleccionó originalmente de una biblioteca genética para unirse particularmente a una versión de "núcleo" truncada proteolíticamente de estreptavidina. A lo largo de los años, el Strep-tag se optimizó sistémicamente para permitir una mayor flexibilidad en la elección del sitio attachment. Además, su socio de interacción, Streptavidin, también se optimizó para aumentar la capacidad de unión de péptidos, lo que resultó en el desarrollo de Strep-Tactin. La afinidad de unión de Strep-tag a Strep-Tactin es casi 100 veces mayor que a Streptavidin. El llamado sistema Strep-tag, que consta de Strep-tag y Strep-Tactin, ha demostrado ser especialmente útil para el aislamiento funcional y el examen de complejos de proteínas en la investigación de proteomas.
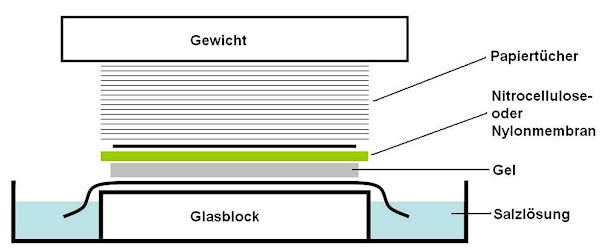
Imagen 273A | Bandeja con pila compuesta de arriba hacia abajo por un peso, toallas de papel, membrana de nitrocelulosa o nailon, gel, solución salina y una losa de vidrio. | Thomasione / Public domain | Page URL : (https://commons.wikimedia.org/wiki/File:Aufbau_Southern-Blot.jpg) from Wikimedia Commons
Autor : Yavor Mendel
Comentarios
Publicar un comentario